精準醫療是萬靈丹嗎?
(健康醫療網/記者蘇湘雲報導)
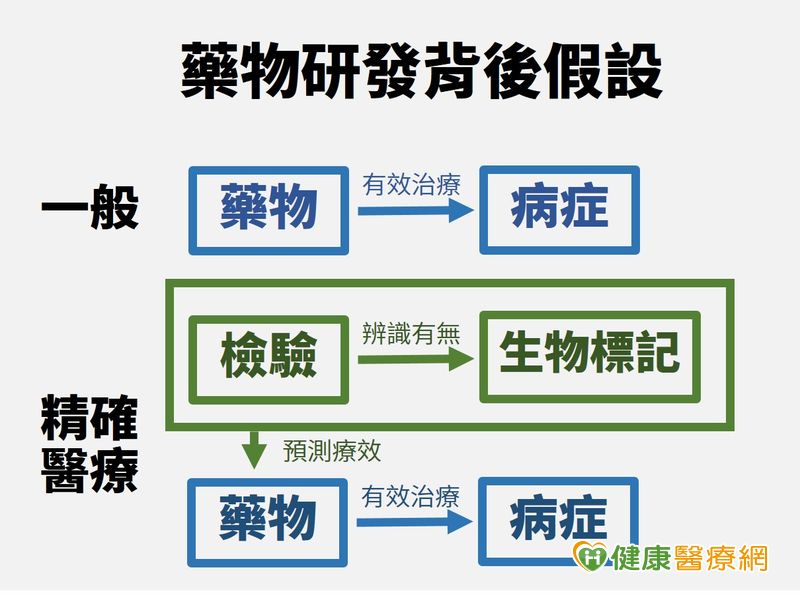
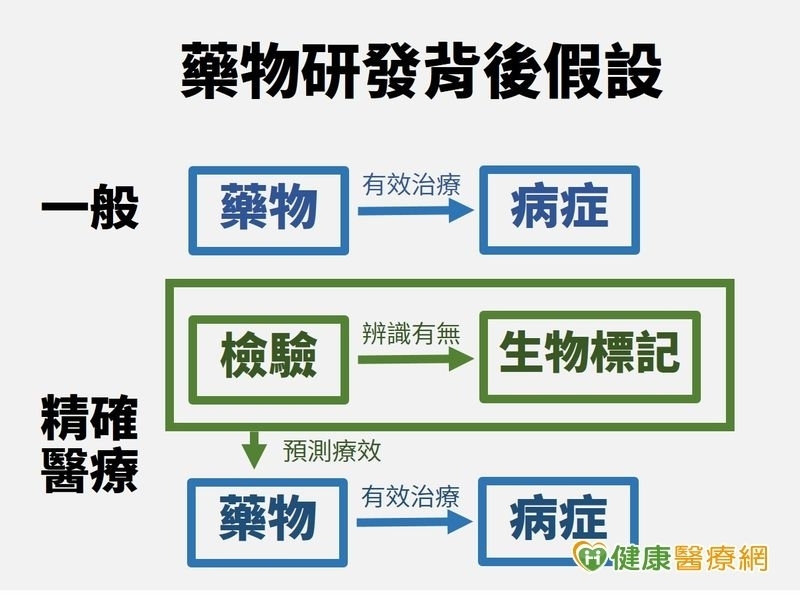
目前在醫學界,「精準醫療」(Precision Medicine)風潮正夯。但精準醫療真的是治療癌症、預防疾病的萬靈丹嗎?國外學者對此提出不少質疑。知名學術期刊《科學》刊載哈佛學者投書,文章指出,精準醫療建立在一連串的假設,當生物標記、檢測與藥物研發過程任一個環節出錯,便會導致巨額研究資源浪費,患者就醫權益也大受影響。
傳統醫療 療效發揮不到60%
傳統醫療多講究「標準療程」,患者治療用藥、療程大同小異。美國統計出這類傳統治療方式發揮療效機率不到百分之六十。目前基因體學蓬勃發展,「精準醫療」不只挑戰傳統藥物治療方式,也讓醫界、藥界更了解為何某些藥物只對特定族群有反應。精準醫療擁護者更希望透過精準醫療為患者量身打造治療計畫,以提升治療反應率。
根據台灣醫學會資料,「精準醫療」是根據腫瘤基因型、個人基因表現、個人健康狀況,以及臨床資料等資訊,量身打造、選擇最適合患者的療程、藥物,或根據這些資訊擬定預防策略,透過這種治療方式,希望讓藥物發揮最大效果,並讓藥物副作用風險降至最低。
精準醫療 研究品質良莠不齊
然而,國外學者質疑,現今許多生物標記以開放科學模式進行,讓參與門檻大幅降低,在提出假設方式、實驗方式沒有一定標準的情況下,研究品質良莠不齊,研究可信度自然大打折扣。
以2004年美國食物藥品管理署核准的爾必得舒注射液(Cetuximab)為例,這種藥物主要提供給轉移性大腸直腸癌「表皮生長因子受體」呈陽性(EGFR-positive)的患者使用,許多健康保險給付將EGFR陰性患者排除。後續研究卻發現,此項藥物對EGFR呈陰性的病人同樣有效,這表示這款藥物與EGFR之間並沒有生物標記、藥物反應率關聯性,這結果不只造成金錢浪費,也讓許多原本可以接受治療的病人,因不符合給付條件而無法用藥。
精準醫療研究 需有一致規範
生物標記檢驗標準不一的問題則在乳癌基因HER2檢測過程浮出檯面。這些檢驗多以檢視細胞表面特定蛋白有無為目標,但不同實驗室對陽性、陰性判斷臨界值卻沒有統一標準。另外,國外33份研究以肺癌標靶「核?酸切除修複交叉互補組基因蛋白1」(ERCC1)為重點,但因診斷方式、測量方法的許多差異,導致結果出現歧異。以上兩個例子都顯示,相關研究若沒有一致的規範、評估機制,便會大幅增加臨床應用的難度。
在今年,美國國家醫學院生物標記、精確醫療相關委員會所發表的文章中,列出十項規範,釐清政府與法人單位的權責,以及衛政、藥檢、保險、臨床與研究機構等相關規範,透過這些規範,希望讓患者不至淪為「不準醫療」的犧牲品。
台灣精準醫療發展腳步遲緩 需更多整合以利進展
台灣生物產業發展協會理事長李鍾熙理事長接受媒體訪問時表示,在精準醫療領域當中,從基因檢測、基因定序,到臨床應用,往往需要投資大量人力。台灣精準醫療發展上,腳步有點遲緩。舉例來說,像台灣人體生物資料庫(Taiwan Biobank)與健保資料可以相互比對,但目前兩個資料庫沒有連結,這些都需要政府進行跨部會、跨領域整合,才能有所進展。
參考資料、文獻來源:
1) 翻譯人員/
國立成功大學醫學院公共衛生研究所兼任助理吳懷玨
2) 參考文獻/
Imprecise research threatens precision medicine
3) 精準醫療/
讓療程客製化 http://www.chinatimes.com/newspapers/20160313000085-260204
4) 參考文獻/
FDA, Enrichment Strategies for Clinical Trials to Support Approval of Human Drugs and Biological Products
5) 參考文獻/
Jeff Shrager, Jay M. Tenenbaum, Rapid learning for precision oncology, Nature Reviews Clinical Oncology 11, 109–118 (2014) doi:10.1038/nrclinonc.2013.244
6) 參考文獻/
HIT Think How precision medicine will support population health management http://www.healthdatamanagement.com/opinion/how-precision-medicine-will-support-population-health-management
7) 資料出處/
科技部補助?新媒體科普傳播實作計畫?執行團隊、科技大觀園
《新媒體科普傳播實作計畫》(計畫編號MOST105-2515-S-006-008)補助產出
資料來源:健康醫療網http://www.healthnews.com.tw/blog/article/29507/view/